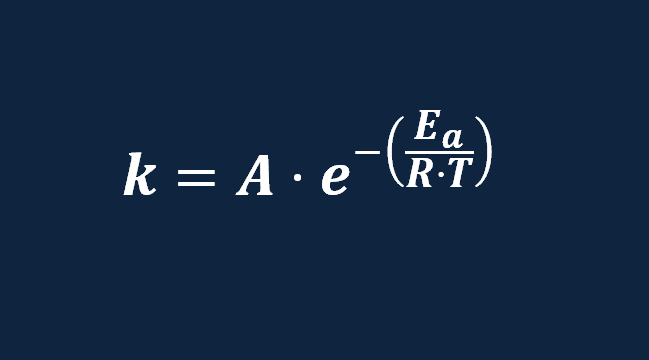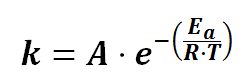Ecuacion de Arrhenius energía de activación explicación de la fórmula ejemplos Trucos y ejercicios resueltos paso a paso desde cero pdf factor de frecuencia , cinética química , ejercicios resueltos pdf Química 2º Bachillerato universidad .
Ejercicio resuelto 01 ver solución
En una determinada reacción a una temperatura de 350 K el factor de frecuencia e A= 3,75·1014 s-1 y la energía de activación 150 KJ/mol . Calcular la constante de velocidad
Ejercicio resuelto 02 ver solución
En una determinada reacción a una temperatura de 350 K , la constate de velocidad es k= 3,2 s-1 el factor de frecuencia es A= 3,75·1014 s-1 Calcular la energía de activación
Si el Blog y el canal de youtube es de utilidad ayudarme a difundir este proyecto siguiendome por las redes sociales y compartiendo nuestro contenido por las redes y por los grupos de whatshap
Factores que afectan a la velocidad de la reacción
Temperatura
En la ecuación de Arrhenius , vemos que si aumentamos la temperatura aumentará la constante de velocidad , por lo tanto aumentará la velocidad de la reacción