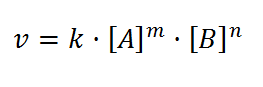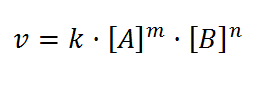Ecuacion de velocidad Cinetica química ,como calcular la constante de velocidad y sus unidades 2º Bachillerato universidad .
total de la reacción tiene diferente unidades
01 ver parte a
|
Experimento
|
[A]
mol/L |
[B]
mol/L |
v
mol/L·s |
|
1
|
0.2
|
0.2
|
8·10-3
|
|
2
|
0.6
|
0.2
|
24·10-3
|
|
3
|
0.2
|
0.4
|
32·10-3
|
Determinar el orden de la reacción y la constante de velocidad
Ejercicios resueltos 02 ver solución
El NO (g) reacciona con (g) para formar N2O (g) y H2O (g). Para dicha reacción se han obtenido los siguientes datos
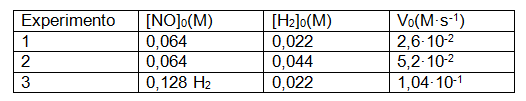
Calcula numéricamente: a) El orden total de la reacción y los órdenes parciales. b) La constante de velocidad de la reacción. c) La velocidad inicial de la reacción para una concentración inicial de los reactivos 0,08 M.
Problema competencial resuelto PAU 2025
En la reacción química expresada de forma genérica como: aA(g) + bB(g) → cC(g) + dD(g), se ha comprobado, en un primer experimento, que si la concentración de A se duplica y la concentración de B permanece constante, la velocidad inicial se multiplica por 4. En otro experimento, se comprobó que al mantener la concentración de A constante y duplicar la concentración de B, la velocidad inicial se duplica. A partir de estos datos, responda razonadamente a las siguientes cuestiones: a. Escriba la expresión de la ley de velocidad de dicha reacción y calcule el orden total de la reacción. (Hasta 1,0 puntos) b. Determine las unidades de la constante de velocidad, k. (Hasta 0,5 puntos) c. Justifique la influencia de la temperatura sobre la velocidad de reacción. (Hasta 0,5 puntos)