Tipos de reacciones orgánicas , Reacciones de sustitución , Reacciones de adición , Reacciones de eliminación , Reacciones de condensación , Reacciones de Hidrólisis , Reacciones Redox , reacciones de orgánica , química 2º bachillerato , universidad , explicación pdf y ejercicios resueltos de examenes , selectiviad , EBAU , EVAU .
ÍNDICE DE reacciones orgánicas
1 Reacciones de sustitución.
2 Reacciones de adición.
3 Reacciones de eliminación.
4 Reacciones de condensación
5 Reacciones de Hidrólisis
6 Reacciones Redox
Al final de la entrada puedes bajarte el pdf con la teoría y los enunciados de los ejercicios
1 Reacciones de sustitución. ver vídeo
Un átomo o grupo de átomos es sustituido por otro
R-X+Y → R- Y + X
Ejemplos :
1.1 Halogenación de hidrocarburos :
CH3-CH3 + Cl2 luz → CH3-CH2-Cl + HCl
( Etano + cloro → Cloroetano + cloruro de Hidrógeno )
1.2 Obtención de alcoholes a partir de halógenos (medio básico)
CH3-CH2-Cl + KOH → CH3-CH2OH + KCl
(Cloroetano + hidróxido de potasio → Etanol + cloruro de potasio )
1.3 Obtención de halógenos a partir de alcoholes (medio ácido)
CH3-CH2OH + HCl → CH3-CH2Cl + H2O
(Etanol + ácido clorhídrico → Cloroetano + agua )
1.4 Reacciones de sustitución clásicas del Benceno (C6H6)
Hay tres reacciones clásicas de sustitución con el benceno :
Halogenación : C6H6 + Cl2 → C6H5Cl + HCl
( Benceno + Cloro → Clorobenceno + cloruro de hidrógeno)
Nitración : C6H6 + HNO3 → C6H5NO2 + H2O
( Benceno + ácido nítrico → Nitrobenceno + agua)
Alquilación : C6H6 + CH3Cl → C6H5 CH3 + HCl
( Benceno + Clorometano → Metilbenceno( tolueno) + cloruro de hidrógeno)
recuerda si el los vídeos te han servido , suscríbete , activa la campanilla , en época de exámenes subimos muchos ejercicios clásicos de exámenes y así estarás informado y compártelo por las redes sociales y grupos de clase 😉 SUSCRIBETE a youtube : http://goo.gl/CMFnu0
2 Reacciones de adición. ver vídeo
Añadimos un átomo o un grupo de átomos a una molécula ( generalmente se rompen enlaces múltiples )
-C=C – + XY → X-C-C –Y
Regla de Markovnikov (El Hidrógeno se une donde hay más H)
2.1 Hidrogenación. Adición de Hidrógeno ( H2)
CH3-CH=CH-CH3 + H2 → CH3-CH2-CH2-CH3
( but-2-eno + Hidrógeno → Butano )
CH3-C ΞC-CH3 + 2H2 → CH3-CH2-CH2-CH3
( but-2-ino + Hidrógeno → Butano )
2.2 Adición de Halógenos ( Br2 ,Cl2…)
CH3-CH2-CH=CH2 + Br2 → CH3-CH2-CHBr –CH2Br
( but-1-eno + Bromo → 1,2-dibromobutano )
CH3-CH2-CΞCH + 2Br2 → CH3-CH2-CBr2 –CHBr2
( but-1-ino + Bromo → 1,1,2,2-tetrabromobutano)
2.3 Adición de halogenuros de Hidrógeno ( HBr ,HCl,…)
CH3-CH2-CH=CH2 + HBr → CH3-CH2-CHBr –CH3
( but-1-eno + Bromuro de Hidrógeno → 2-bromobutano )
2.4 Formación de alcoholes. Adición de agua (H2O)
CH3-CH=CH2 + H2O → CH3-CHOH-CH3
( propeno + Agua → propan-2-ol )
recuerda que si esta página te ha servido , ayúdanos a crecer compartiéndonos por las redes sociales y por los grupos de whastsapp
3 Reacciones de eliminación. ver vídeo
Al revés de las de adición , es decir eliminamos un átomo o un grupo de átomos a una molécula ( generalmente se forman enlaces múltiples )
X-C-C –Y → -C=C – + XY
3.1 Deshidratación de alcoholes. Se elimina un grupo OH y un átomo de Hidrógeno del carbono contiguo que menos H tenga (Regla de Saytzeff) . Generalmente se realiza en presencia de ácido sulfúrico ( H2SO4) obteniéndose un alqueno
CH3-CH2-CH2OH H2SO4 → CH3-CH=CH2 + H2O
( propan-1-ol →propeno + agua)
CH3-CHOH-CH2-CH3 H2SO4 → CH3-CH=CH-CH3 + H2O
( but-2-ol → but-2-eno + agua)
3.2 Deshidrogenación de halógenos.
Se elimina un átomo de un halógeno( Cl , Br, …) y un átomo de Hidrógeno del carbono contiguo que menos H tenga (Regla de Saytzeff), Generalmente se realiza en presencia de hidróxido de potasio (KOH) obteniéndose un alqueno.
CH3-CHCl-CH2-CH3 KOH → CH3-CH=CH-CH3 + HCl
(2-clorobutano → but-1-eno + Cloruro de Hidrógeno )
recuerda si el los vídeos te han servido , suscríbete , activa la campanilla , en época de exámenes subimos muchos ejercicios clásicos de exámenes y así estarás informado y compártelo por las redes sociales y grupos de clase 😉 SUSCRIBETE a youtube : http://goo.gl/CMFnu0
4 Reacciones de condensación
Tiene lugar cuando dos moléculas orgánicas se unen eliminado otra molécula pequeña, generalmente agua.
Las reacciones de condensación más importantes son :
4.1 Esterificación
CH3– CH2– COOH + CH3-CH2OH → CH3– CH2-COO-CH2-CH3 + H2O
( ácido propanoico + etanol → propanoato de etilo + agua)
4.2 Formación de una Amida (Ácido +Amina à Amida + Agua )
CH3-COOH + CH3-NH2 → CH3-CONH-CH3 + H2O
( ácido acético + metanamina → N-metiletanamida + agua)
Para practicar lo que hemos aprendido hasta ahora te recomiendo que hagas el ejercicio 01 que hay al final del pdf
5 Reacciones de Hidrólisis
Es un tipo de reacción opuesto a la condensación
Las reacciones de Hidrólisis más importantes son :
5.1 Hidrólisis en medio Básico .Saponificación( Formación de jabones )
R-COOR’ + NaOH → R-COONa + R’OH
( Ester + Base → Ester metálico + alcohol )
5.2 Hidrólisis de ésteres en medio ácido (proceso inverso a la Esterificación)
CH3– CH2-COO-CH2-CH3 + H2O → CH3– CH2– COOH + CH3-CH2OH
(propanoato de etilo + agua → ácido propanoico + etanol)
6 Reacciones Redox
6.1 Reacciones de oxidación
6.1.1 reacciones de combustión ( combustible + O2 → CO2+ H2O)
Ejemplo combustión del etanol: ( Consejo ajusta la reacción )
CH3-CH2OH + 3O2 → 2CO2+ 3H2O
6.1.2 oxidación de alcoholes
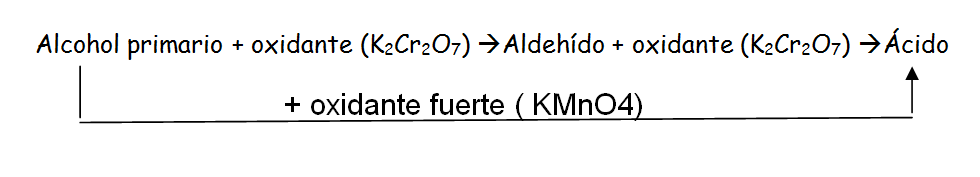
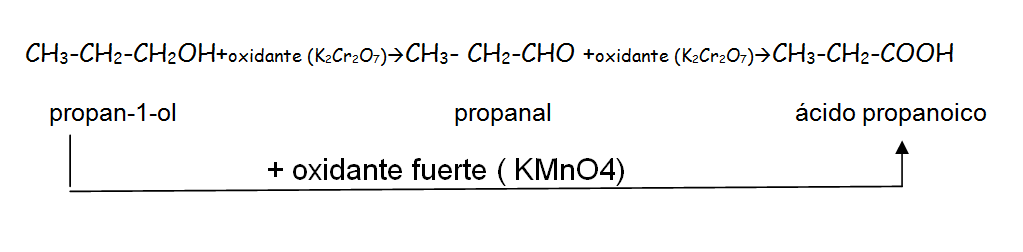
Alcoholes primarios: La oxidación de alcoholes primarios en presencia de un oxidante como el dicromato potásico (K2Cr2O7) conduce a aldehídos . Si se continúa con la oxidación llegaremos al ácido . Si utilizamos el permanganato de potasio ( KMnO4) , que es un oxidante más fuerte llegamos al ácido directamente.
Alcoholes secundarios: En la oxidación de un alcohol secundario obtenemos cetonas
Alcohol secundario + oxidante → Cetona
CH3-CHOH-CH3+oxidante → CH3– CO- CH3
propan-2-ol propanona
6.2 Reacciones de reducción
Se produce la reacción inversa que vimos en la oxidación de los alcoholes
6.2.1 Reducción de ácidos a alcoholes
Ácido + reductor fuerte à Alcohol primario
CH3– CH2– CH2-COOH + reductor fuerte → CH3– CH2– CH2-C H2OH
6.2.1 Reducción de aldehídos y cetonas en alcoholes
Generalmente se utiliza como reductor el Hidruro de litio y aluminio LiAlH4
Aldehído + reductor (LiAlH4) → Alcohol primario
CH3– CH2-CHO + reductor (LiAlH4) → CH3-CH2-CH2OH
propanal propan-1-ol
Cetona + reductor (LiAlH4) → Alcohol secundario
CH3– CO- CH3 + reductor (LiAlH4) → CH3-CHOH-CH3
propanona propan-2-ol
Aquí tienes también el enlace al curso para transformarte en una máquina de la formulación orgánica CURSO FORMULACIÓN Y NOMEMCLATURA ORGÁNICA
Ejercicios de tipos de reacciones orgánicas resueltos
Ejercicio resuelto 01 Para cada una de las siguientes reacciones, formule y nombre todos los compuestos orgánicos que intervengan:
a) (0,5 puntos) CH3–CH2–CHOH–CH3 + H2SO4/calor →
b) (0,5 puntos) CH3OH + CH3COOH + H+→
c) (0,5 puntos) CH3–CH=CH–CH3 + HCl →
d) (0,5 puntos) CH3−CH2−COOH + NH2−CH2−CH3 →
OTRAS ENTRADAS QUE TE PUEDEN INTERESAR:
Experimentos reacciones químicas








