Reacciones ácido base y cálculo de pH Teoría explicaciones ejemplos y ejercicios resueltos en vídeo paso a paso , química 2 bachillerato y universidad . En este tema daremos las carácterísticas de los ácidos y de las bases las diferentes teorías ácido base [Arrhenius , Brönsted-Lowry , Lewis ] , el producto iónico del agua y el concepto de pH , los ácidos y bases fuertes y débiles , la hidrólisis de sales , la neutralización y las valoraciones y realizaremos muchos ejercicios clásicos de examen resueltos paso a paso hasta que te conviertas en una máquina del tema.
Clasificación y diferencia entre ácidos y bases fuertes y débiles
Teorías ácido base [ Arrhenius , Brönsted-Lowry , Lewis ] Ejercicios resueltos
Ácidos y bases Ph . reacciones de transferencia de protones
Diluciones ( repaso muy interesante de disoluciones )
Adivina el color de la infusión Experimentos con ph
Disoluciones reguladoras ,tampón amortiguadoras
Recopilación de ejercicios del tema de ácido base resueltos de exámenes
Experimento en el que inflamos un globo
libro vídeo en Bubok pH ácido base + Autoevaluación exclusiva
Características generales de los ácidos y de las bases
ver vídeo explicativo del tema
| Características de los ácidos | Características de las bases |
| Tienen sabor ácido | Tienen sabor amargo |
| Reaccionan con los metales desprendiendo hidrógeno | Reaccionan con las grasas produciendo jabón |
| Neutralizan las bases | Neutralizan los ácidos |
| Reaccionan con las bases produciendo sales | Reaccionan con los ácidos produciendo sales |
Teorías ácido base [Arrhenius , Brönsted-Lowry , Lewis ]
Teoría de Arrhenius
Los ácidos son sustancias que liberan iones H+ ( protones ) en disoluciones acuosas
Ejemplo : HCl → H++ Cl–
Las bases son sustancias que liberan iones OH– en disoluciones acuosas
Ejemplo : NaOH → Na++ OH–
Algunas limitaciones de esta teoría:
Están restringidas a disoluciones acuosas
Existen bases como el NH3 , Na2CO3 …que no contienen OH–
No explica porqué las disoluciones de algunas sales presentan propiedades ácidas o básicas
Teoría de Brönsted-Lowry
Definición de Ácido Brönsted-Lowry
Es una sustancia capaz de ceder H+ ( protones )
Ejemplo 1: CH3COOH + H2O ↔ CH3COO– + H3O+
en este ejemplo vemos como el CH3COOH ( ácido acético ) cede un protón al agua , luego actúa como ácido
Definición de Base Brönsted-Lowry
es una sustancia capaz de captar H+ ( protones )
Ejemplo 2 NH3 + H2O ↔ NH4+ + OH–
en este ejemplo vemos como el NH3 ( amoniaco ) capta un protón al agua , luego actúa como base
Sustancias anfóteras
Las sustancias anfóteras son aquellas que pueden actuar como ácido y como base
En el ejemplo 1 vemos que el agua capta un protón y el el 2 como cede un protón , luego el agua es una sustancia anfótera
limitaciones de esta teoría:
No explica el carácter ácido de algunas sustancias que no tienen protones ( AlCl3, BF3)
Teoría de Lewis:
Ácido sustancia capaz de aceptar y compartir un par de electrones
Base sustancia capaz de de ceder y compartir un par de electrones
Ejercicios Teoría Brönsted-Lowry resueltos
Ejemplo resuelto 01
Según la teoría Brönsted-Lowry justifica si las siguientes especies químicas se comportan como ácidos o como bases. Indica cual es su ácido o base conjugada. Ver solución en vídeo
a) CH3COOH b)C6H5COOH c)HCOOH d) HCN e) H2SO4
f) NH3 g)C6H5NH2
Ejemplo resuelto 02
Según la teoría Brönsted-Lowry justifica si las siguientes especies químicas se comportan como ácidos o como bases. Indica cual es su ácido o base conjugada. ver solución en vídeo
h) CN– i) CH3COO– k) NH4+ l) HSO4–
Producto Iónico del agua Kw Concepto de pH
Equilibrio iónico del agua
H2O(l) + H2O(l) ↔ H3O+(aq) + OH–(aq)
Cuadro resumen de producto iónico del agua y concepto de pH
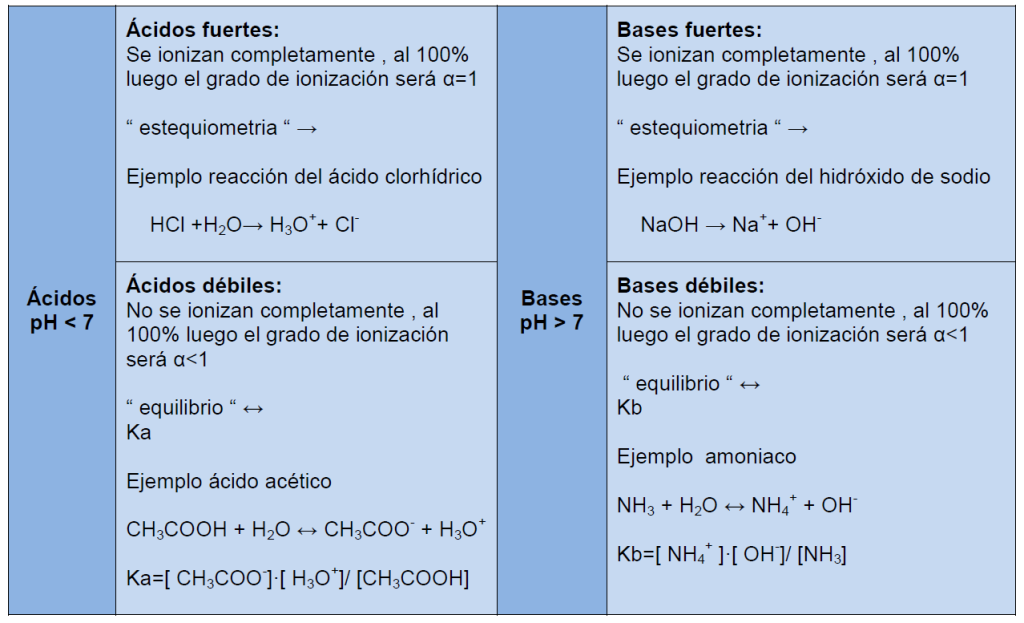
Ácidos y bases | fuertes y débiles
VER VIDEO DONDE EXPLICO EL SIGUIENTE CUADRO RESUMEN
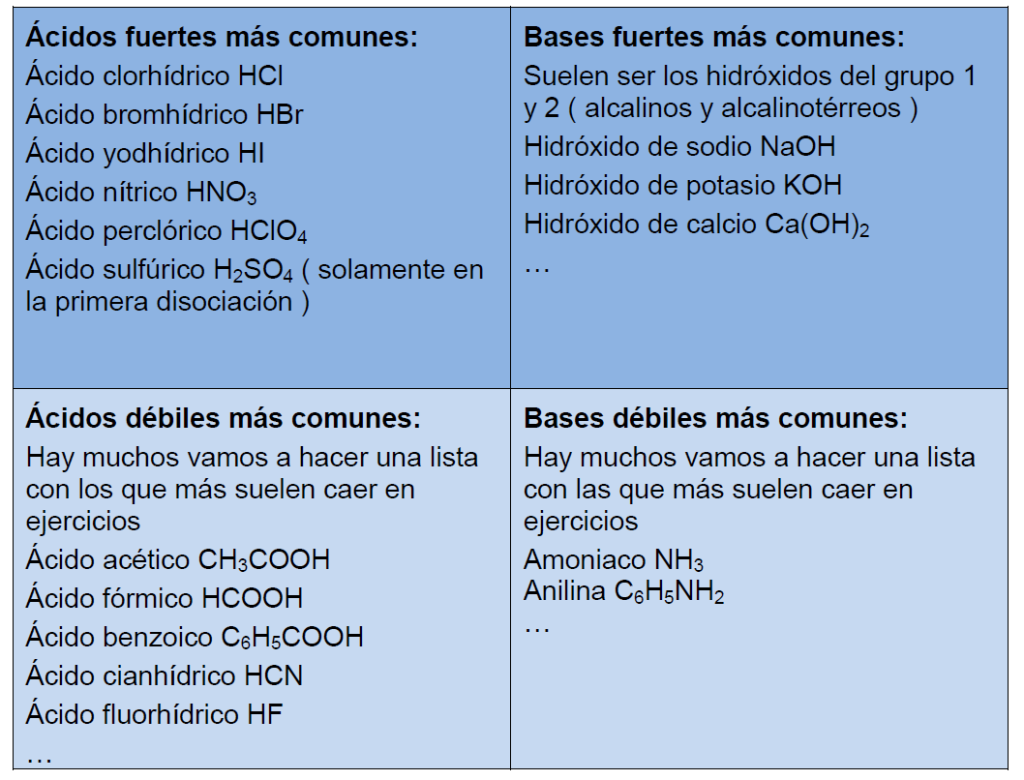
lista de ácidos y bases fuertes y débiles
Aunque a lo largo del curso de ácido base y pH os enseñaré un truco infalible para saber si el ácido es fuerte o débil y la base es fuerte o débil , os dejo un resumen con los ácidos y bases fuerte y débiles más comunes en los ejercicios y exámenes Puedes hacer captura de esta tabla
Ejercicios resueltos pH ácidos y bases , fuertes y débiles pH y grado de disociación
Ácidos fuertes y bases fuertes
Ácidos fuertes
Ejercicios resueltos ver solución
Calcular el pH de una disolución 0,001 Molar de ácido clorhídrico
Ejercicios resueltos ver solución
Calcular la concentración de una disolución de ácido clorhídrico si su pH=2,5
Bases fuertes
Ejercicios resueltos ver solución
Calcular el pH de una disolución 0,0025 Molar de hidróxido de sodio
Ácidos débiles y bases débiles
Ácidos débiles
Ejercicios resueltos ver solución
Calcular el pH de una disolución 0,1 Molar de ácido acético
Dato : Ka=1,8·10-5
Ejercicios resueltos ver solución
Calcular el grado de disociación y el ph de una disolución 0,2 Molar de ácido acético
Dato : Ka=1,8·10-5
Bases débiles
Ejercicios resueltos ver solución
Calcular el ph de una disolución 0,05 Molar de amoniaco
Dato : Kb=1,8·10-5
Ejercicios resueltos ver solución
Calcular el grado de disociación y el pH de una disolución 0,1 Molar de amoniaco
Dato : Kb=1,8·10-5
Ejercicios resueltos de ácidos y bases fuertes y débiles
Ejercicios resueltos muy interesante veremos cómo diferenciar un ácido y una base fuerte y débil Ver solución
Calcula el pH y el grado de disociación de las siguientes disoluciones de concentración 0,1M grabado sin subir
a) Acido cianhídrico
b) Hidróxido de calcio
c ) Anilina
d) Acido clorhídrico
pKa(HCN)=9,2 pKb (C6H5NH2)=9,4
Ejercicios resueltos de exámenes cálculo de pH
Vamos a realizar varios ejercicios de exámenes del temario dado hasta ahora , ambos son ejercicios de selectividad y son bastante clásicos de examen
Ejemplo resuelto
El grado de disociación de una disolución 0’03 M de hidróxido de amonio (NH4OH) es 0’024. Calcule la constante de disociación (Kb) del hidróxido de amonio y el pH de la disolución. Ver solución
Ejercicio muy interesante
Se disuelven 10,8 g de ácido cloroso, HClO2, en agua suficiente hasta 525 mL finales de disolución.
a) Calcula el pH de la disolución resultante.
b) Calcula el volumen de agua que hay que añadir a la disolución anterior para que el pH sea 2, considerando que los volúmenes sean aditivos. DATO: Ka = 0,0115.
DILUCIONES Repaso importante de disoluciones
Fórmula de disoluciones que me simplifica muchos problemas : C1·V1=C2·V2 para el cálculo de molaridades o volúmenes necesarios para cálculos de pH ¿cuándo la puedo usar? ¿Cómo?.
HIDRÓLISIS de sales
Hidrólisis de una sal de ácido fuerte y base fuerte
Razonar el carácter ácido , básico o neutro de una disolución de NaCl ver solución
Hidrólisis de una sal de ácido fuerte y base débil
Razonar el carácter ácido , básico o neutro de una disolución de NH4Cl
Dato Kb (NH3)= 1,8·10-5 ver solución
Hidrólisis de una sal de ácido débil y base fuerte
Razonar el carácter ácido , básico o neutro de una disolución de CH3COONa
Dato Ka (CH3COOH)= 1,8·10-5 ver solución
Hidrólisis de una sal de ácido débil y base débil
Razonar el carácter ácido,básico o neutro de una disolución de CH3COONH4
Dato Ka (CH3COOH)= 1,8·10-5 Kb (NH3)= 1,8·10-5 ver solución
Hidrólisis de sales ejercicios resueltos
Ejemplo ejercicio clásico de examen resuelto
Deduce si el pH de las siguientes disoluciones acuosas de las siguientes sales, es neutro , ácido o básico : ver solución
a) NaF
b) NaCl
c) NH4Cl
d) NH4CN
Datos : Ka(HCN)=6,2·10-10 ; Ka(HF)=6,7·10-4 ;Kb(NH3)=1,8·10-5
Hidrólisis de sales Ejercicios resueltos
Calcular el pH de una disolución 0,2 Molar de cianuro de sodio
Dato Ka(HCN)=4,9·10-10 ver solución
Grado de hidrólisis Ejercicios resueltos
Calcular el pH y el grado de hidrólisis de una disolución 0,1 Molar de acetato sódico Dato Ka(CH3-COOH)=1,8·10-5 ver solución
Ejercicio resuelto selectividad 2022
Considere disoluciones acuosas de idéntica concentración de los compuestos: HCl, NH4I, NaBr y KCN.
a) (1 punto) Deduzca, sin hacer cálculos, si las disoluciones son ácidas, básicas o neutras. Escriba las reacciones correspondientes.
b) (1 punto) Ordénelas, razonadamente, en orden creciente de pH.
Datos. Ka (HCN) = 4,9×10–10; Kb (NH3) = 1,8×10–5 .
Neutralización ácido base
Neutralización ácido fuerte base fuerte
Ejercicios resueltos
Calcular el volumen necesario de una disolución de NaOH 0,4 M para neutralizar 250 mL de una disolución de HCl 0,2 M ver solución
Ejercicios resueltos
Calcular el volumen necesario de una disolución de HCl 0,5 M para neutralizar 400 mL de una disolución de Ca(OH)2 0,3 M ver solución
Neutralización por estequiometria
Calcular el volumen de una disolución 0,3M de HCl necesaria para neutralizar 600 ml de una disolución 0,1M de Ca(OH)2 ver solución
Ejercicio resuelto de Neutralización y pH
Se añaden 7 g de amoníaco en la cantidad de agua necesaria para obtener 500 mL de disolución.
Calcula:
El pH de la disolución resultante.
¿Qué volumen de HCl 0,1 M se necesitará para neutralizar completamente 250 mL de la disolución anterior?
Datos: Kb=1,8·10-5 Masas atómicas: N = 14; H = 1
Valoración de ácido fuerte y base fuerte Ejercicios resueltos
Ejercicios resueltos 01 ver solución
Se valoran 0,25 litros de una disolución 0,2 molar de HCl con 0,4 litros de una disolución 0,1 molar de NaOH . Calcular el pH de la disolución resultante
Ejercicios resueltos 02 ver solución
Se valoran 0,25 litros de una disolución 0,2 molar de HCl con 0,55 litros de una disolución 0,1 molar de NaOH . Calcular el pH de la disolución resultante
Ejercicios resueltos 03 ver solución
Se valoran 0,25 litros de una disolución 0,4 molar de HCl con 0,18 litros de una disolución 0,25 molar de Ca(OH)2 . Calcular el pH de la disolución resultante
Ejercicios resueltos Disoluciones reguladoras , amortiguadoras
Calcular el pH de una disolución reguladora que en 0,75 litros contiene 0,15 moles de NH3 y 0,250 moles de NH4Cl Dato Kb(NH3)= 1,8·10-5 ver solución
Ejercicios resueltos de exámenes
Clásico de examen 1
Se tiene una disolución de KOH de 2,4 % de riqueza en masa y 1,05 g · mL–1 de densidad. Basándose en las reacciones químicas correspondientes, calcula: a) La molaridad y el pH de la disolución b) Los g de KOH que se necesitan para neutralizar 20 mL de una disolución de H2SO4 0,5 M. DATOS: H = 1 u; K = 39 u; O = 16 u.
Clásico 2
A.2 Responda las siguientes cuestiones:
a) (1 punto) Obtenga el porcentaje de riqueza en masa de una muestra de hidróxido de sodio, sabiendo que 100 g de muestra son neutralizados con 100 mL de una disolución de ácido clorhídrico 12 M.
b) (1 punto) Calcule el pH de una disolución preparada al añadir 22 g de la muestra de hidróxido de sodio del apartado anterior, a 200 mL de una disolución de ácido clorhídrico 2,0 M. Considere que no hay cambio de volumen.
Datos. Masas atómicas (u): H = 1; O = 16; Na = 23.
Ejercicio resuelto Nivel full Se dispone de una disolución A de ácido clorhídrico comercial de densidad 1,19 kg · L–1 y riqueza 38 % en masa. Para preparar una segunda disolución B, se toman 10,0 mL de la disolución A, diluyéndose con agua destilada hasta un volumen final de 15,0 litros.
a) Calcula la concentración (en moles · L–1) del ácido clorhídrico comercial (disolución A).
b) Calcula la concentración (en moles · L–1) de la disolución B y su pH.
c) A 50,0 mL de la disolución B, se añaden 25,0 mL de una disolución 0,01 moles · L–1 de Ca (OH)2. Calcula el pH de la disolución final. Considera que los volúmenes son aditivos.
Datos: Masas atómicas relativas: H = 1,0; Cl = 35,5. Kw = 10–14
Ejercicio modelo cero 2024 selectividad
Se tiene una disolución de KOH de 2,4% de riqueza en masa y 1,05 g·mL-1 de densidad. Basándose en las reacciones químicas correspondientes, calcule:
a) La molaridad y el pH de la disolución.
b) Los gramos de KOH que se necesitan para neutralizar 20 mL de una disolución de H2SO4 0,5M.
Datos: Masas atómicas relativas: H= 1; K= 39; O= 16
enlaces a nuestros CURSOS gratis que te pueden interesar
Matemáticas 2º bachillerato ciencias y tecnológico
Matemáticas 2º bachillerato ciencias aplicadas a las ciencias sociales
UNIVERDIDAD Matemáticas Física Química y Estadística