Energía de ionización [ potencial de ionización ] y su variación en la tabla periódica Resumen , ejemplos y ejercicios resueltos . Primera energía de ionización y energías de ionización sucesivas ( segunda , tercera …) Química 2 bachillerato y universidad
La ENERÍA DE IONIZACIÓN pertence al tema de propiedades periódicas , y es importante dominar primero el apantallamiento y la carga nuclear efectiva , aqui tienes en enlace Y también el tema de RADIO ATÓMICO
Energía de ionización EI [ potencial de ionización ] definición
¿Qué es la energía de ionización en la tabla periódica? ver vídeo
Definición La energía de ionización es la mínima energía necesaria para extraer el electrón más externo de un átomo neutro , X , en estado gaseoso y en su estado electrónico fundamental , dando lugar a un ion monopositivo X+ también en estado gaseoso fundamental
X(g) + EI → X+(g) + 1e–
Este proceso siempre es endotérmico ( el átomo absorbe energía )
(Podemos interpretar la energía de ionización como la energía con la que el átomo retiene al electrón , luego cuanto mayor es la EI , el electrón estará más retenido a este )
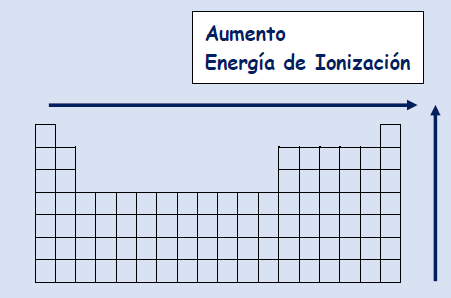
Justificación Variación de la energía de ionización en la tabla periódica
Periodo Dentro de un mismo periodo la energía de ionización aumenta de izquierda a derecha
Explicación A lo largo de un periodo aumenta la carga nuclear efectiva Z* de izquierda a derecha ya que aumenta el número atómico pero el apantallamiento no . Al aumentar la carga nuclear efectiva ejerce mayor atracción sobre los electrones de valencia , disminuyendo el radio, por lo tanto los electrones externos estarán más fuertemente atraídos y tendremos que suministrar una mayor energía para extraerlos
Grupo Dentro de un mismo grupo la energía de ionización disminuye al descender en el grupo
Explicación Al descender en un grupo aumenta el número de capas electrónicas aumentando el radio atómico , los electrones al aumentar el radio estarán menos atraídos por el núcleo , siendo menor la energía de ionización
Ejemplo Resuelto
Ordena los siguientes elementos en orden creciente a su Energía de Ionización
a) Na ( Z=11) Cl ( Z=17) P( Z= 15)
b) P( Z= 15) Sb( Z= 51) N( Z=7)
a) Como el Na , Cl y P pertenecen al mismo periodo
EI Na < EI P < EI Cl
b) Como el P , Sb y N pertenecen al mismo grupo
EI Sb < EI P < EI N
Energía de ionización sucesivas
PARA ENTENDERLO MEJOR Y JUSTIFICARLO PERFECTAMENTE MIRA ESTE VIDEO
En función del número de electrones del átomo podemos hablar de la primera , segunda , tercera, … energía de ionización , que corresponde , con la energía necesaria para arrancar del átomo el primer , segundo , tercer … electrón
X(g) + EI1 → X+(g) + 1e–
X+(g) + EI2 → X2+(g) + 1e–
X2+(g) + EI3 → X3+(g) + 1e–
Las sucesivas energías de ionización serán mayores cada vez
EI1 < EI2 < EI3 …
Explicación Al disminuir los electrones tendrá un menor apantallamiento para el mismo número atómico , luego la carga nuclear efectiva aumentará , al aumentar la carga nuclear efectiva disminuye el radio por lo tanto los electrones externos estarán más fuertemente atraídos y tendremos que suministrar una mayor energía para extraerlos
Ejercicio resuelto sucesivas energías de ionización [ clásico de examen ]
Las energías sucesivas de ionización para el berilio Be( Z=4) son
EI1= 0.899 EI2= 1.757 EI3 = 14.849 (en eV/átomo)
Justifica el valor tan alto de la tercera energía de ionización
solución
Be (g) + EI1 → Be+ (g) + 1e–
Be+ (g) + EI2 → Be2+ (g) + 1e–
Be2+ (g) + EI3 → Be3+ (g) + 1e–
Las sucesivas energías de ionización serán mayores cada vez
EI1 < EI2 < EI3 …
Explicación Al disminuir los electrones tendrá un menor apantallamiento para el mismo número atómico , luego la carga nuclear efectiva aumentará , al aumentar la carga nuclear efectiva disminuye el radio por lo tanto los electrones externos estarán más fuertemente atraídos y tendremos que suministrar una mayor energía para extraerlos
El valor tan alto de la tercera energía de ionización , es debido a que el Be al perder dos electrones adquiere la configuración electrónica de gas noble Be2+ → 1s2 → [ He] , lo que le confiere una mayor estabilidad , por esto se requiere mucha más energía para arrancar el tercer electrón.
Ahora que ya somos unas máquinas de la energía de ionización sigamos con las propiedades periódicas asi que …
VAMOS A POR LA AFINIDAD ELECTRÓNICA !!!!!!!!!!!!!
TE DEJO LOS ENLACES a LAS PROPIEDADES PERIÓDICAS !!!!!!!!!!!!!!!!!!!!
ESQUEMA DE PROPIEDADES PERIÓDICAS , APANTALLAMIENTO Y CARGA NUCLEAR EFECTIVA
RADIO IÓNICO [ y sustancias isoelectrónicas]
OTRAS ENTRADAS QUE TE PUEDEN INTERESAR
Ciclo de Born Haber ejercicios resueltos
Formulación inorgánica tabla periódica








