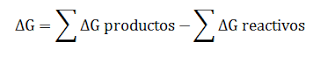Ejercicios resueltos energía libre de Gibbs , reacciones espontaneas , termoquímica química reacciones 1º 2º bachillerato acceso y universidad
Energía libre de Gibbs Espontaneidad de una reacción
La energía libre de Gibbs (G) es una función de estado extensiva que mide la espontaneidad de una reacción química.
Es muy importante interpretar el signo de la energía libre de Gibbs
∆G>0 Reacción NO espontanea
∆G<0 Reacción espontanea
∆G=0 Equilibrio químico
Podemos calcular la energía libre de Gibbs de tres formas .
1 De forma cuantitativa

Tenemos que saber que las variaciones de energía libre de formación de los elementos en su estado fundamental (natural) son cero , y las de los compuestos diatómicos también .
Ejemplos resueltos
Calcular la variación de energía libre de Gibbs estándar que tiene lugar en la siguiente reacción , ¿ se trata de una reacción espontánea?
CH4 (g) + O2 (g) → CO2 (g) + H2O (l)
DATOS: ΔG0 (CO2) =– 394,4 kJ/mol; ΔG0 [H2O (l)] = – 237,2 kJ/mol; ΔG0 (CH4) = -50,8 kJ/mol.
2 De forma cuantitativa
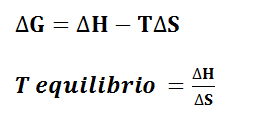
OJOla entalpía esta tabulada en KJ y la entropía en julios , luego para aplicar estas dos fórmulas , tenemos que ponerlas en las mismas unidades . Mi consejo es pasar la entropía a KJ dividiéndola entre mil.
Ejemplos resueltos
Para una determinada reacción, a 25 ºC, los valores de DHº y DSº son, respectivamente, 10,5 kJ y 30,0 J/K. a) Justificar numéricamente si la reacción será espontánea o no b) calcular la temperatura a la que el sistema está en equilibrio.
Energia libre de gibbs ejercicios resueltos
Ejercicios resueltos 02
Utilizando los valores que aparecen en la tabla, todos obtenidos a la temperatura de 25ºC, y considerando la reacción CO(g) + Cl2(g) → COCl2(g) ver solución
a) Calcule ∆So de la reacción.
b) Calcule ∆Ho de la reacción.
c) Calcule ∆Go de la reacción.
|
S0
(J/mol·K ) |
∆Ho
(KJ/mol) |
|
|
CO
(g) |
197,7
|
-110,4
|
|
Cl2
(g) |
222,8
|
0,0
|
|
COCl2
(g) |
288,8
|
-222,8
|
3 De forma cualitativa ( cuadrito)
|
∆H
|
∆S
|
∆G
|
|
|
Negativa
|
Positiva
|
Negativa
|
Espontanea a cualquier T
|
|
Positiva
|
Negativa
|
Positiva
|
NO Espontanea a
cualquier T |
|
Positiva
|
Positiva
|
a T baja
Positiva
|
NO espontanea a T
baja |
|
a T alta Negativa
|
Espontanea
a T alta
|
||
|
Negativa
|
Negativa
|
a T baja Negativa
|
Espontanea a T baja
|
|
a T alta
Positiva
|
NO espontanea a T
alta |
Cómo calcular el intervalo de Temperatura en el que la reacción es espontánea
Ejercicio resuelto competencial PAU 2025
El estudio termodinámico de la unión de proteínas en el cuerpo humano resulta trascendental para el diseño de fármacos en el tratamiento de enfermedades. En la tabla adjunta se muestran los valores de ∆Hº y ∆Gº asociados a dos uniones: (1) el citocromo C con el anticuerpo monoclonal Mab 2B5 a 25ºC, y (2) el receptor gp130CHR con la oncostatina M a 10ºC.
| Unión | Proteína 1 | Proteína 2 | T (°C) | ΔH° (kJ·mol⁻¹) | ΔG° (kJ·mol⁻¹) |
| (1) | Citocromo C | Mab 2B5 | 25 | −87,8 | −52,7 |
| (2) | gp130CHR | Oncostatina M | 10 | −8,0 | −43,1 |
A la vista de los datos proporcionados, calcule: a. El valor de ∆Sº para las dos uniones a las temperaturas de la tabla. (Hasta 0,8 puntos) b. El intervalo de temperatura en el que las uniones se producen espontáneamente. (Hasta 1,2 puntos) Ver solución
OTRAS ENTRADAS QUE TE PUEDEN INTERESAR
CURSO DE FÍSICA Y QUÍMICA 3º ESO
CURSO DE MATEMÁTICAS 1º BACHILLERATO
CURSO DE MATEMÁTICAS SOCIALES 1º BACHILLERATO
CURSO DE FÍSICA Y QUÍMICA 1º BACHILLERATO
CURSO MATEMÁTICAS 2 BACHILLERATO
UNIVERSIDAD MATEMÁTICAS FÍSICA Y QUÍMICA