Termodinámica 2 bachillerato ejercicios resueltos paso a paso del tema de termoquímica
Recopilación de problemas de exámenes del curso y de selectividad con CLAVES y TRUCOS para ser una máquina del tema. Si tienes examen no te puedes perder esta entrada
Esta entrada pertenece al
Curso para ser una máquina de QUÍMICA 2º BACHILLERATO
Curso para ser una máquina de TERMOQUÍMICA
Termodinámica 2 bachillerato ejercicios resueltos
Índice del tema de termoquímica
Reacciones termoquímicas. Ecuaciones
Reacciones de combustión y de formación
Primer principio de la termodinámica
Energía libre de Gibbs Espontaneidad de una reaccion
Ecuaciones termoquímicas Ejercicios resueltos
Ejercicio 01
A partir de la siguiente ecuacion termoquimica:
2 HgO (s) → 2 Hg (l) + O2 (g) ΔHR= + 181,6 kJ
a) Calcula el calor necesario para descomponer 50 g de HgO.
b) Determina el volumen de oxigeno, medido a 25oC y 1 atm, que se produce al suministrar 418 kJ al oxido de mercurio.
Datos Masas atómicas Hg=200,6 ;O=16 ver solución
Ejercicio 02
Sabemos que la combustión del carbono en forma de grafito, a la presión de 1 atm y a 25 ºC, posee un calor de reacción de – 390KJ/mol. Calcula la cantidad de oxígeno necesaria para que se obtengan 525KJ. ver solución
Datos Masas atómicas O=16
Ejercicio 03
El calor de combustión del propano( C3H8), a 25ºC y presión de 1 atmósfera, es – 2220 KJ/mol. Calcula qué cantidad de energía puede obtenerse de una bombona de 8 Kg de gas de un 75% de riqueza. ver solución
Datos Masas atómicas C=12;H=1
Ejercicios de entalpia de reacción resueltos
Fórmula

Tenemos que saber que las variaciones de entalpía de formación de los elementos en su estado fundamental (natural) son cero , y las de los compuestos diatómicos también .
Interesante
Condiciones normales P=1atm T=0ºC
Condiciones estándar P=1atm T=25ºC
Ejercicio 01
Las entalpías estándar de formación del CH4 (g), CO2 (g) y H2O (l) son, respectivamente, -74,9 KJ/mol; -393,5 KJ/mol y -285,8
KJ/mol. Calcula la entalpía estándar de combustión del metano. ver solución
Ejercicio 02
Dada la reacción del carburo cálcico con agua:
CaC2 (s) + H2O (l) → Ca(OH)2 (s) + C2H2 (g).
a) Calcula su variación de entalpía estándar. ver solución
DATOS: ΔHºf (CaC2) = – 59,0 kJ/mol; ΔHºf [H2O (l)] = – 285,8 kJ/mol ΔHºf [Ca(OH)2]= – 986,0 kJ/mol; ΔHºf (C2H2) = 227,0 kJ/mol.
Ejercicio 03
¿Qué calor se desprende en la combustión de 100 dm3 de acetileno, C2H2, medidos a 25 ºC y 1 atm? ver solución
DATOS: ΔHºf (CO2) =–- 393,5 kJ/mol; ΔHºf [H2O (l)] = – 285,8 kJ/mol; ΔHºf (C2H2) = 227,0 kJ/mol.
Si los videos te han servido , dale al 🔥 LIKE y SUSCRíBETE y activa la campanilla 🔔, en época de exámenes subimos muchos ejercicios clásicos de exámenes y así estarás informado ➡ compártelo por las redes sociales y grupos de clase 😉
Ejercicio 04
La entalpía de combustión del benceno líquido(C6H6) es – 3.267,4 KJ/mol . Calcula:
a) El valor de la entalpía de formación del benceno líquido.
b) La energía implicada en la combustión de 100 g de benceno líquido.
DATOS: DHof [CO2 (g)] = – 393,5 KJ/mol; DHof [H2O (l)] = – 285,8 KJ/mol.
Masas atómicas C=12;H=1 parte1 parte 2
Reacciones de combustión y de formación
Ejercicios resueltos
Formula y ajusta las siguientes reacciones de formación
a) Reacción de formación del agua
b) Reacción de formación del CO2
c) Reacción de formación del NH3
d) Reacción de formación del C2H4
e) Reacción de formación del C6H6
f) Reacción de formación del C6H12O6
Ejercicios resueltos
Formula y ajusta las siguientes reacciones de combustión
a) Reacción de combustión del C2H4
b) Reacción de combustión del C
c) Reacción de combustión del H2
d) Reacción de combustión del C2H4
e) Reacción de combustión del C6H6
f) Reacción de combustión del C6H12O6
f) Reacción de combustión del CO
Si los videos te han servido , dale al 🔥 LIKE y SUSCRíBETE y activa la campanilla 🔔, en época de exámenes subimos muchos ejercicios clásicos de exámenes y así estarás informado ➡ compártelo por las redes sociales y grupos de clase 😉
Ley de Hess
Ejercicios resueltos 01
Calcula la entalpia estándar de la reacción: C (s) + 2 H2 (g) → CH4 (g) a partir de los siguientes datos:
C (s) + O2 (g) → CO2 (g) ΔH0= -393,5 kJ
H2 (g) +1/2 O2 (g) → H2O (l) ΔH0= -285,8 kJ
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l) ΔH0= -890,4 kJ
Ejercicios resueltos 02
Calcula la entalpia estándar de la reacción de síntesis del disulfuro de carbono, CS2 (l), a partir de sus elementos, C (s), y azufre, S (s), a partir de estos datos:
C (s) + O2 (g) → CO2 (g) ΔH0= – 393,5 kJ
S (s) + O2 (g) → SO2 (g) ΔH0 = -296,1 kJ
CS2 (l) + 3 O2 (g) → CO2 (g) + 2 SO2 (g) ΔH0 = – 1072 kJ
Ejercicios resueltos 03
Los calores de combustión a 25 ºC del carbono(s) y del benceno (l) son, respectivamente –394,7 KJ/mol y –3267 KJ/mol, y el de formación del agua (l) es de –285,9 KJ/mol. Calcule:
a) El calor de formación del benceno.
Ejercicios resueltos 04
Para la reacción de hidrogenación del eteno C2H4 (g) + H2 (g) →C2H6 (g)
a) Calcule la variación de entalpía de la reacción a partir de los siguientes datos: Calor de combustión del etileno = -1386,09 KJ/mol; Calor de combustión del etano = -1539,9 KJ/mol; Calor de formación del agua (l) = -285,8 KJ/mol.
Si los videos te han servido , dale al 🔥 LIKE y SUSCRíBETE y activa la campanilla 🔔, en época de exámenes subimos muchos ejercicios clásicos de exámenes y así estarás informado ➡ compártelo por las redes sociales y grupos de clase 😉
Ejercicios resueltos 05
La glucosa se fermenta a etanol y dióxido de carbono según la siguiente reacción C6H12O6 → 2 C2H5OH + 2CO2 Calcula
a) La entalpía estándar de la reacción
b) La energía desprendida en la obtención de 4,6 g de etanol
Datos Entalpías de combustión estándar : Glucosa = -2813 KJ/mol Etanol = -1367KJ/mol Masas atómicas ( C=12;O=16;H=1) ver solución
Entalpía de enlace
Fórmula

Ejercicios resueltos 01
El propano ( C3H8) es uno de los combustibles fósiles más utilizados.
a) Formula y ajusta su reacción de combustión.
b) Calcule la entalpía estándar de combustión e indique si el proceso es exotérmico o endotérmico.
Datos: Energía media de enlace (KJ·mol-1) C – C = 347, C– H = 415, O – H = 460, O = O := 494, C = O = 730
Ejercicios resueltos 02
El proceso Deacon para la obtención del cloro gaseoso se basa en hacer reaccionar cloruro de hidrógeno y oxígeno gaseosos.
a) Formule la ecuación ajustada del proceso, sabiendo que, además de cloro, se obtiene vapor de agua.
b) Determine la variación de entalpía por mol de cloro formado, interpretando el resultado obtenido, a partir de los valores siguientes de las entalpías de enlace.
Datos: Entalpías de enlace (KJ/mol) de H-Cl = 432; O=O = 499 KJ/mol; Cl-Cl = 243; H-O = 460.
Ejercicios primer principio de la termodinámica
Primer principio de la termodinámica
Fórmula
∆H=∆H+∆nRT
Siendo
∆H la variación de entalpía (kJ)
∆U la variación de energía interna (kJ)
∆n número de moles gaseosos de los productos – número de moles gaseosos de los reactivos
T temperatura (K)
Importante R= 8,31·10-3 kJ/K·mol
También tenemos que saber que :
Qp=∆H ( calor a presión constante)
Qv=∆U ( calor a volumen constante)
W= ∆nRT ( trabajo)
Ejercicios resueltos
A partir de la siguiente ecuación termoquímica en condiciones estandar:
2 HgO (s) → 2 Hg (l) + O2 (g) ΔHR= + 181,6 kJ
Calcula :
a) Variación de la energía interna
b) Qp
c)Qv
d) trabajo
Si los videos te han servido , dale al 🔥 LIKE y SUSCRíBETE y activa la campanilla 🔔, en época de exámenes subimos muchos ejercicios clásicos de exámenes y así estarás informado ➡ compártelo por las redes sociales y grupos de clase 😉
Entropía (S)
La entropía es una función de estado, que mide el grado de desorden de un sistema.
El segundo principio de la termodinámica afirma que la entropía del universo, en un proceso espontáneo aumenta
Podemos calcular la entropía de dos formas .
1 De forma cuantitativa ( ojo la entropía esta tabulado en julios)

2 De forma cualitativa
TRUCO
Como ∆S tendrá el mismo signo que ∆n , entonces calculamos ∆n
Si ∆n>0 ⇒ ∆S>0 Aumenta el desorden de la reacción ( Sistema)
Si ∆n<0 ⇒ ∆S<0 Disminuye el desorden de la reacción ( Sistema)
Ejercicios de entropia resueltos
Ejercicios resueltos 01
Para el proceso N2O (g) + 3/2O2 (g) → 2 NO2 (g) a 298 K, calcula:
a) La entropía de reacción
DATOS: Sº (N2O) = 220,1 J/mol K; Sº(NO2) = 240,1 J/mol K; Sº (O2) = 205,2 J/mol K.
Ejercicios resueltos 02
Predice si en cada una de las siguientes reacciones hay variación positiva o negativa de la entropía:
a) 2 KClO4 (s) → 2 KClO3 (s) + O2 (g)
b) H2O (g) → H2O (l)
c) N2 (g) → 2N (g)
Ejercicios resueltos 03
Predice el signo de la entropía en las siguientes reacciones:
a) 2 NH3 (g) → N2 (g) + 3 H2 (g)
b) C3H8 (g) + 5 O2 (g) →3 CO2 (g) + 4 H2O (l)
Energía libre de Gibbs Espontaneidad de una reacción
La energía libre de Gibbs (G) es una función de estado extensiva que mide la espontaneidad de una reacción química.
Es muy importante interpretar el signo de la energía libre de Gibbs
∆G>0 Reacción NO espontanea
∆G<0 Reacción espontanea
∆G=0 Equilibrio químico
Podemos calcular la energía libre de Gibbs de tres formas .
1 De forma cuantitativa

Tenemos que saber que las variaciones de energía libre de formación de los elementos en su estado fundamental (natural) son cero , y las de los compuestos diatómicos también .
Ejemplos resueltos
Calcular la variación de energía libre de Gibbs estándar que tiene lugar en la siguiente reacción , ¿ se trata de una reacción espontánea?
CH4 (g) + O2 (g) → CO2 (g) + H2O (l)
DATOS: ΔG0 (CO2) =– 394,4 kJ/mol; ΔG0 [H2O (l)] = – 237,2 kJ/mol; ΔG0 (CH4) = -50,8 kJ/mol.
2 De forma cuantitativa

OJO la entalpía esta tabulada en KJ y la entropía en julios , luego para aplicar estas dos fórmulas , tenemos que ponerlas en las mismas unidades . Mi consejo es pasar la entropía a KJ dividiéndola entre mil.
Ejemplos resueltos
Para una determinada reacción, a 25 ºC, los valores de DHº y DSº son, respectivamente, 10,5 kJ y 30,0 J/K. a) Justificar numéricamente si la reacción será espontánea o no b) calcular la temperatura a la que el sistema está en equilibrio.
Energia libre de gibbs ejercicios resueltos
Ejercicios resueltos 02
Utilizando los valores que aparecen en la tabla, todos obtenidos a la temperatura de 25ºC, y considerando la reacción CO(g) + Cl2(g) → COCl2(g) ver solución
a) Calcule ∆So de la reacción.
b) Calcule ∆Ho de la reacción.
c) Calcule ∆Go de la reacción.
| S0 (J/mol·K ) |
∆Ho (KJ/mol) |
|
| CO (g) |
197,7 | -110,4 |
| Cl2 (g) |
222,8 | 0,0 |
| COCl2 (g) |
288,8 | -222,8 |
Si los videos te han servido , dale al 🔥 LIKE y SUSCRíBETE y activa la campanilla 🔔, en época de exámenes subimos muchos ejercicios clásicos de exámenes y así estarás informado ➡ compártelo por las redes sociales y grupos de clase 😉
3 De forma cualitativa ( cuadrito)
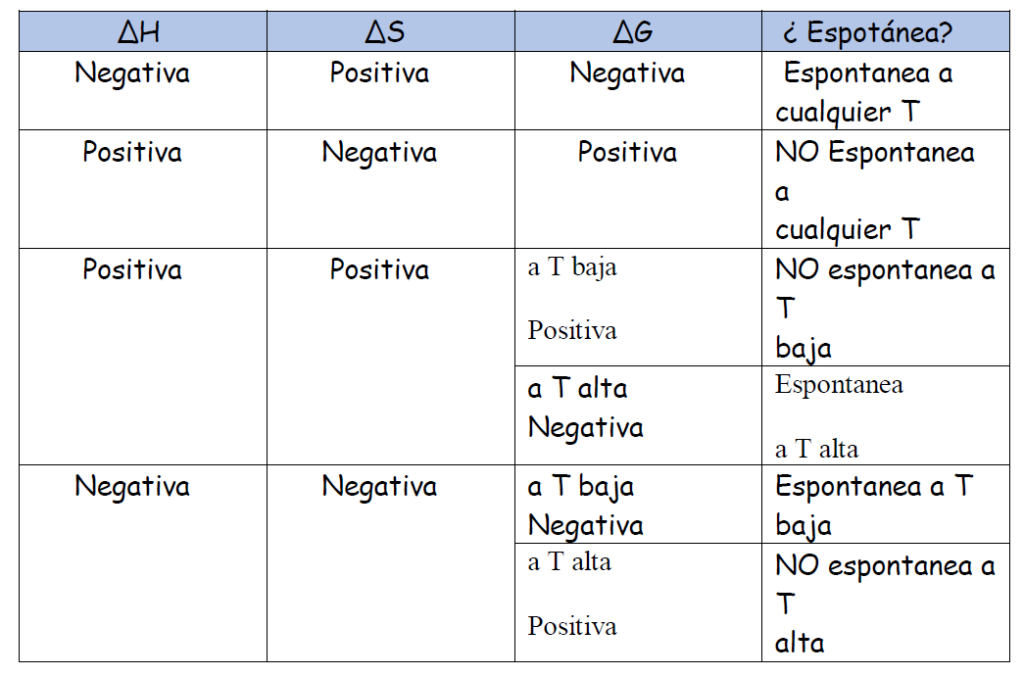
Ejercicos resueltos de Termodinámica selectividad
Junio CyL 2014
Las entalpías de combustión del 1,3-butadieno, C4H6 (g); hidrógeno, H2 (g); y butano, C4H10 (g), son: –2539,4 kJ/mol, –286,1 kJ/mol y –2879,1 kJ/mol, respectivamente. En todos los casos, el agua formada está en estado líquido.
a) Escriba las ecuaciones de esas reacciones de combustión.
b) Calcule la energía de la siguiente reacción de hidrogenación del 1,3-butadieno a butano:
C4H6 (g) + 2 H2 (g) → C4H10 (g)
Sep 2014 CyL
Para el proceso N2O (g) + 3/2 O2 (g) → 2 NO2 (g) a 298 K, calcule:
a) La entalpía de reacción indicando si es un proceso exotérmico o endotérmico.
b) La variación de entropía y energía libre. Indique si se trata de un proceso espontáneo en estas condiciones, y en qué intervalo de temperaturas lo será (suponga que la entalpía y la entropía no varían con la temperatura).
Datos: ∆Hºf N2O = 81,6 kJ/mol; ∆Hºf NO2 = 33,2 kJ/mol Sº N2O = 220,1 J/mol·K; Sº NO2 = 240,1 J/mol·K; Sº O2 = 205,2 J/mol·K
Ejercicio 02 Selectividad Pau CyL Sep 2013
Dada la reacción del carburo cálcico con agua:
CaC2 (s) + H2O (l) → Ca(OH)2 (s) + C2H2 (g).
- a) Calcula su variación de entalpía estándar. ver solución
DATOS: ΔHºf (CaC2) = – 59,0 kJ/mol; ΔHºf [H2O (l)] = – 285,8 kJ/mol ΔHºf [Ca(OH)2]= – 986,0 kJ/mol; ΔHºf (C2H2) = 227,0 kJ/mol.
Ejercicio 03 Selectividad CyL Sep 2013
¿Qué calor se desprende en la combustión de 100 dm3 de acetileno, C2H2, medidos a 25 ºC y 1 atm? ver solución
DATOS: ΔHºf (CO2) =–- 393,5 kJ/mol; ΔHºf [H2O (l)] = – 285,8 kJ/mol; ΔHºf (C2H2) = 227,0 kJ/mol.
Ejercicio 04 Selectividad CyL junio 2012
La entalpía de combustión del benceno líquido(C6H6) es – 3.267,4 KJ/mol . Calcula:
- a) El valor de la entalpía de formación del benceno líquido.
- b) La energía implicada en la combustión de 100 g de benceno líquido.
DATOS: DHof [CO2 (g)] = – 393,5 KJ/mol; DHof [H2O (l)] = – 285,8 KJ/mol.
Masas atómicas C=12;H=1 parte1parte 2
Si los videos te han servido , dale al 🔥 LIKE y SUSCRíBETE y activa la campanilla 🔔, en época de exámenes subimos muchos ejercicios clásicos de exámenes y así estarás informado ➡ compártelo por las redes sociales y grupos de clase 😉
Esta entrada pertenece al Curso para ser una máquina de TERMOQUÍMICA
Curso para ser una máquina de QUÍMICA 2º BACHILLERATO
OTRAS ENTRADAS QUE TE PUEDEN INTERESAR
CURSO DE FÍSICA Y QUÍMICA 3º ESO
CURSO DE MATEMÁTICAS 1º BACHILLERATO
CURSO DE MATEMÁTICAS SOCIALES 1º BACHILLERATO
CURSO DE FÍSICA Y QUÍMICA 1º BACHILLERATO








