Modelos atómicos explicación esquemas resúmenes y características de los modelos principales dados en el tema de estructura de la materia de Física y química ESO Bachillerato Dalton Thomson Rutherford
Modelos atómicos
Los modelos atómicos son una representación de la estructura del átomo para tratar de explicar su comportamiento y sus propiedades
Pequeña reseña histórica
En la antigua Grecia surgieron diferentes teorías filosóficas para explicar la estructura de la materia
En el siglo V a C Demócrito postuló que la materia estaba formada por partículas muy pequeñas e indivisibles a las que llamó átomos
En el siglo IV a C Aristóteles negó la idea de átomo y postuló la teoría de los cuatro elementos es decir que la materia estaba formada por la combinación de tierra ,agua ,aire y fuego esta teoría fue aceptada durante muchísimos siglos.
Con los avances científicos de finales del siglo XVIII y de principios de XIX Dalton retomó la idea de Átomo .
Modelo Atómico de Dalton (1808)
5 postulados
Los elementos están constituidos por partículas muy pequeñas denominadas átomos , que son indivisibles
Los átomos de un mismo elemento son iguales entre sí , tienen la misma masa y las mismas propiedades
Los átomos de distintos elementos tienen diferentes masas y propiedades distintas
Los compuestos están formados por la unión de diferentes átomos , que guardan una relación sencilla de números enteros entre si
En las reacciones químicas los átomos ni se crean ni se destruyen , se redistribuyen para crear nuevos compuestos
Ejemplo : C + O2 → CO2
Modelo atómico de Thomson explicación
En 1897 Joseph John Thomson descubrió los electrones a través del experimento de los rayos catódicos
En 1904 después de descubrir el electrón J.J Thomson propuso un modelo atómico nuevo
Básicamente suponía la existencia de una esfera de masa positiva uniforme (todavía no se habían descubierto los protones , ni los neutrones) Con electrones encajados y distribuidos uniformemente.
Las carga positiva de la esfera, se compensaría con las cargas de los electrones , resultando un átomo neutro
A este modelo se le llama comúnmente , como modelo “ pastel de pasas” , a mi me gusta más llamarlo el “bollo con pepitas de chocolate”

Esquema resumen Modelo atómico de Thomson Características principales
- El átomo consiste en una esfera de masa positiva uniforme, con electrones encajados y distribuidos uniformemente
- Las carga positiva de la esfera, se compensaría con las cargas de los electrones , resultando un átomo neutro
Modelo Atómico de Rutherford
Experimento de Rutherford
En 1911 bombardeó con partículas alfa ( que están cargadas positivamente) una delgada lámina de oro , y observó los choques de las partículas que la atravesaban sobre una pantalla situada detrás de la lámina.
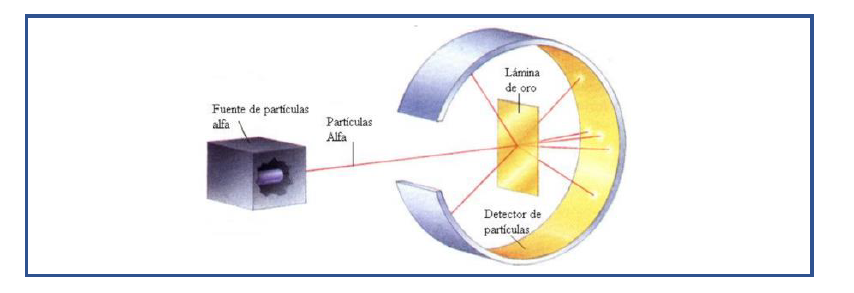
Rutherford esperaba que siguiendo el modelo atómico de Thomson , las partículas no se desviasen , ya que los átomos tendrían carga uniformemente distribuida.

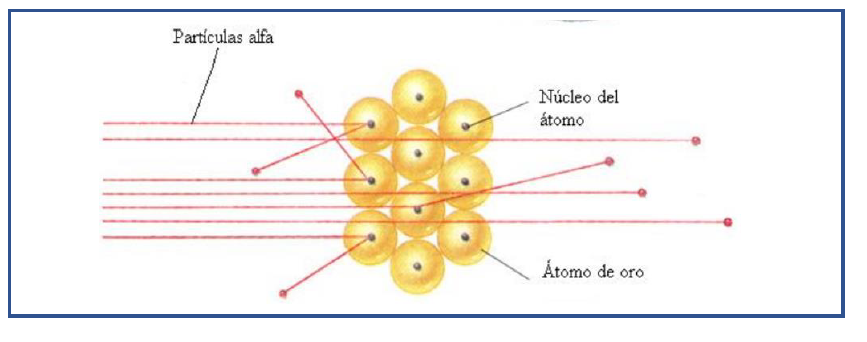
Observó que esto era lo que ocurría en la mayoría de los casos , pero algunas partículas alfa se desviaban de su trayectoria y lo más importante algunas rebotaban hacia atrás (aprox 1 de cada 20.000 ), la deducción de Rutherford fue que esto solo era posible si las partículas alfa se encontraban con corpúsculos positivos y de gran densidad
Gracias a estos resultados propuso un nuevo modelo atómico
Modelo atómico de Rutherford
Conclusiones experimento de Rutherford
La materia está prácticamente “hueca “ , ya que la mayor parte de las partículas alfa la atraviesan sin desviarse
Las partículas alfa se desvían al pasar cerca de las partículas positivas , y revotan cuando “ chocan “ como esto ocurre raramente , estas partículas ocupan un espacio muy pequeño que denominaremos núcleo.
En el núcleo se encuentra toda la carga positiva y casi toda la masa del átomo
Deben existir cargas neutras en el núcleo para que sea estable
Los electrones deben girar alrededor del núcleo
A este modelo se le llama comúnmente , como “modelo planetario“
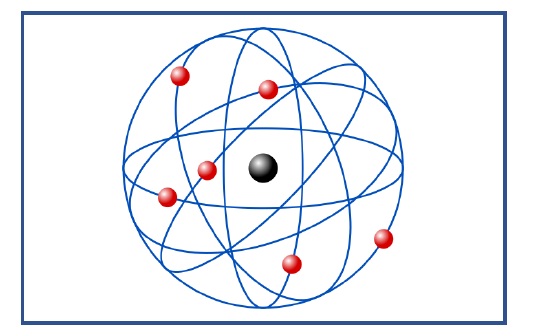
Resumen Modelo Atómico de Rutherford Características principales
- Toda la carga positiva y la mayor parte de la masa del átomo se encuentran en una zona minúscula central denominada núcleo. La mayor parte del átomo está vacía.
- La magnitud de la carga positiva de cada átomo es diferente para cada elemento, y aproximadamente la mitad de la masa atómica del elemento
- En la corteza, los electrones , giran en orbital circulares alrededor del núcleo , siendo el número de electrones igual al de las cargas positivas. De esta forma el elemento es neutro.
OTRAS ENTRADAS QUE TE PUEDEN INTERESAR
CURSO DE FÍSICA Y QUÍMICA 3º ESO
CURSO DE MATEMÁTICAS 1º BACHILLERATO
CURSO DE MATEMÁTICAS SOCIALES 1º BACHILLERATO
CURSO DE FÍSICA Y QUÍMICA 1º BACHILLERATO
CURSO MATEMÁTICAS 2 BACHILLERATO
UNIVERSIDAD MATEMÁTICAS FÍSICA Y QUÍMICA







