Electrólisis Ejercicios resueltos paso a paso desde cero Ley de Faraday Química 2 bachillerato y universidad , celdas electrolíticas , para transformarte en una maquína del tema de reacciones de transferencia de electrones , redox , pilas galvánicas y electrólisis
Electrólisis
Proceso en el que se utiliza el paso de una corriente eléctrica por una disolución o electrolito fundido para producir una reacción Redox No espontánea.
El recipiente donde se realiza la electrólisis se llama cuba o celda electrolítica
Igual que en una pila galvánica en el electrodo donde se produce la reducción se llama cátodo y el electrodo donde se produce la oxidación ánodo , pero ahora el cátodo es negativo y el ánodo positivo
Ejemplos de electrólisis
Recarga de baterías
Producción de algunos metales como el aluminio y el magnesio
Producción de hidrógeno
Proteger a los metales de la corrosión
Electrólisis del agua
La electrólissis del agua suele caer mucho en exámenes tanto en forma teórica , como aplicación práctica en problemas , es por esto que es un clásico de examen
La reacción de descomposición del agua no es espontánea , para que se produzca es necesaria un aporte de energía , que será suministrada mediante una corriente eléctrica ( electrólisis) , como el agua pura no conduce la electricidad , es necesario realizar una disolución acuosa , generalmente se utiliza ácido sulfúrico o hidróxido de sodio .
Se producen las siguientes reacciones :
Ánodo | oxidación (+): 2H2O(l) →O2(g) + 4 H+(aq) +4 e-
Cátodo |reducción (-): 2H+ (aq) +2e- → H2(g)
Reacción global : 2H2O(l) → O2(g)+ 2H2(g)
Segunda ley de Faraday
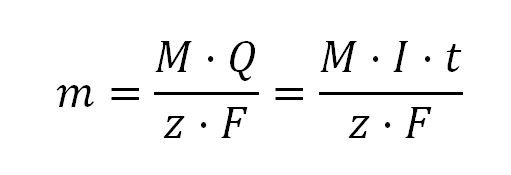
Siendo:
m la masa en gramos
M La masa atómica
Q la carga en culombios (C)
I la intensidad de corriente en amperios (A)
t el tiempo en segundos
F la constante de Faraday
z Número de electrones intercambiados en la semireacción
Es interesante tener en cuenta que igual que en las pilas galvánicas, la reducción se produce en el cátodo y la oxidación en el ánodo, sin embargo, en la electrólisis el cátodo es negativo y el ánodo es positivo , mientras en la pila galvánica es al revés
Ejercicios resueltos de electrólisis
Si los videos te han servido , dale al 🔥 LIKE y SUSCRíBETE y activa la campanilla 🔔, en época de exámenes subimos muchos ejercicios clásicos de exámenes y así estarás informado ➡ compártelo por las redes sociales y grupos de clase 😉
Ejercicio Resuelto 01
En una celda electrolítica conteniendo CuCl2 fundido se hace pasar una cierta cantidad de corriente durante 2 horas, observándose que se deposita cobre metálico y se desprende cloro.
a) Disocie la sal y escriba ajustadas las reacciones que se producen en el ánodo y en el cátodo.
b) Determine la intensidad de corriente necesaria para depositar 15,9 g de cobre.
c) Calcule el volumen de cloro obtenido a 25 ºC y 1 atm. Datos. Masa atómica: Cu = 63,5. F = 96485 C. R = 0,082 atm·L·mol−1·K−1
Ejercicio clásico de examen [ selectividad EVAU ]
Se lleva a cabo la electrólisis de una disolución acuosa de cobre (II). a) (1 punto) Escriba las reacciones que se producen en el cátodo y en el ánodo y calcule la carga necesaria para depositar 7,5 g de cobre. b) (1 punto) Si se utiliza la misma carga del apartado anterior para llevar a cabo la electrólisis del agua, ¿qué volumen de hidrógeno se desprende a 33 ºC y 726 mmHg? Datos. R = 0,082 atm·L·mol–1 ·K–1 . F = 96485 C·mol–1 . Masa atómica (u): Cu = 63,5.
Tema redox
Pilas galvánicas ejercicios resueltos
otros enlaces que te pueden interesar:
Ion Común solubilidad ejercicios resueltos
Química 2º Bachiller ejercicios y problemas resueltos
Equilibrios Heterogéneos Ejercicios resueltos
Discontinuidad evitable de salto finito e infinito
OTRAS ENTRADAS QUE TE PUEDEN INTERESAR
CURSO DE MATEMÁTICAS 1º BACHILLERATO
CURSO DE MATEMÁTICAS SOCIALES 1º BACHILLERATO
CURSO DE FÍSICA Y QUÍMICA 1º BACHILLERATO
CURSO MATEMÁTICAS 2 BACHILLERATO
UNIVERSIDAD MATEMÁTICAS FÍSICA Y QUÍMICA








