Ejercicios y problemas resueltos con solución en vídeo, de física y química, gases 4 de secundaria ESO , bachiller y universidad
Fórmulas Ver explicación 1 ver explicación 2
Tenemos que saber 2 cosas
- Todo gas ocupa todo el volumen del recipiente que lo contiene
- La presión total es la suma de las presiones parciales

Ejemplo 1 En un balón de 5 L, se tiene una muestra que contiene 2,43 moles de nitrógeno y 3,07 moles de oxígeno, a 298 K. Determina: ver solución
- a) la presión total de los gases en el balón
- b) la presión parcial de cada gas en el recipiente , por las leyes de Dalton
Ejemplo 2 En un recipiente de capacidad 10 litros contiene una mezcla de gases formada por 50 gr de oxígeno y 100 gramos de nitrógeno . Si la presión total del recipiente son 3 atm . Calcular las presiones parciales de cada gas.
Dato Masas atómicas: N = 14; O = 16; ver solución
Ejemplo 3 Un recipiente de 2 litros contiene, a 27ºC, una mezcla de gases formada por 0,8 gramos de monóxido de carbono,1,6 gramos de dióxido de carbono y 1,4 gramos de metano(CH4) Calcular:
- a) El número de moles de cada gas.
- b) La fracción molar de cada gas.
- c) La presión total y la parcial de cada gas.
Masas atómicas: C = 12; O = 16; H = 1 ver parte 1 parte 2
Ejemplo 4 Una mezcla de gases a la presión de 700 mm de Hg contiene en porcentaje en volumen un 60 % de cloro, un 10 % de neón y un 30 % de argón.
Calcula las presiones parciales de cada uno ver solución
varios me habéis preguntado porque me pongo pesado con el me gusta . Ahí os dejo un video explicando el porque

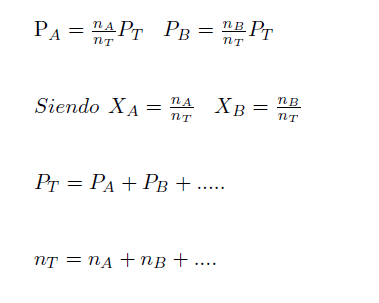







14 comentarios
Hola, el último ejercicio de ley de Dalton, lo hice antes de ver el vídeo para ver si me salía y el resultado ha sido el mismo pero utilizando otro mecanismo. Primero he pasado los 700 mm Hg a ATM y me ha dado 0,92. Y luego simplemente he sacado el % concreto de esta cifra (60% de 0,92 = (0,92*60)/100 = 0,55 atm). ¿Estaría bien igualmente o se tiene que usar la fracción molar?
Muy bien :))
Correcto máquina!!!!!!!
Me prodria dar 10 ejemplos de la ley de da ton por favor es una tarea y no consigo nada
lo siento por ahora solo tengo estos ejercicios
Me gusta!
Gracias, me vienen genial las explicaciones.
Todo perfecto, un gusto que sea gratuito. Gracias.
EXCELENTE
holaa, tengo un problema en este ejercicio:
En un laboratorio tenemos una bombona de 6 litros que contiene gas nitrógeno a la presión de 4 atm. y otra de 8 litros que contiene gas hidrógeno a la presión de 9 atm. se conectan ambas bombonas haciendo que la temperatura se mantenga en 25 ºC durante todo el proceso.Calcula: a) la presión total al final del proceso y la presión que ejerce cada gas de la mezcla. b) la composición de la mezcla como porcentaje en volumen. c) la composición de la mezcla como porcentaje en masa.
aqui tengo uno parecido
http://profesor10demates.blogspot.com.es/2014/08/examenes-gases-quimica-fisica.html
no me había fijado en los exámenes jejeje muchas gracias 🙂
Por favor, donde encuentro alguna explicacion del modelo atómico de Rutherford ?????
Lo siento no lo tengo
hola profesor quisiera comunicarme conu su persona como puedo contactarlo